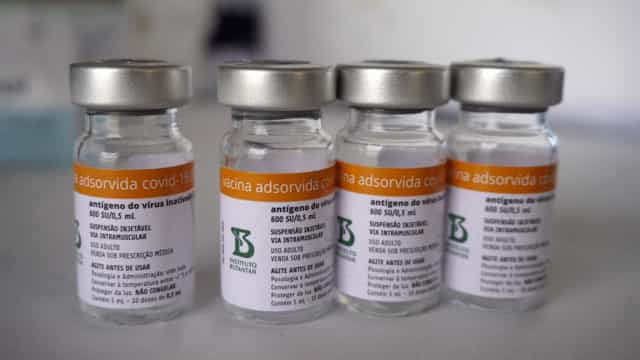
BRASÍLIA, DF (FOLHAPRESS) – A Anvisa (Agência Nacional de Vigilância Sanitária) voltou a suspender nesta terça-feira (11) o prazo de análise do pedido do Instituto Butantan de vacinação do público de 3 a 17 anos com a Coronavac.
Em nota, a agência disse que pediu “esclarecimentos adicionais” sobre estudo conduzido pelo governo chileno sobre a vacinação dos mais jovens com este imunizante, além de ajustes no plano de gerenciamento de risco da aplicação das doses.
A Anvisa e o Butantan marcaram reunião para a manhã de quinta-feira (13) para discutir os dados exigidos, além de “eventuais compromissos, em caso de autorização de uso da vacina”, disse a agência.
Representantes das sociedades médicas também vão participar da reunião com o laboratório ligado ao governo paulista.
O órgão regulador ainda cobra dados de estudo global conduzido na China, África do Sul, Chile, Malásia e Filipinas sobre o uso da vacina. Em novembro, o laboratório chinês Sinovac anunciou que dados preliminares deste ensaio de fase 3 apontam segurança na vacinação do grupo de 3 a 17 anos.
O Butantan encaminhou no dia 15 de dezembro à Anvisa a documentação sobre o pedido de vacinação de crianças e adolescentes. No dia 22, a agência fez a primeira exigência técnica, travando o prazo de 30 dias de análise.
Procurada, a Anvisa informou que já foram usados 16 dos 30 dias de prazo de análise sobre a aplicação da Coronavac em crianças e adolescentes. Ou seja, a agência ainda terá 14 dias para avaliar o pleito do Butantan quando a contagem for retomada.
Em agosto, a diretoria da Anvisa negou pedido de uso da Coronavac no grupo de 3 a 17 anos sob argumento de falta de dados.
Integrantes da agência afirmam que o processo, agora, está mais sólido, mas ainda aguardam dados principalmente do Chile e do estudo global. O país andino já imunizou 1,4 milhão de pessoas entre 3 e 17 anos.
As mesmas autoridades da agência dizem que há diversas opções em análise, como conceder uma autorização de uso por considerar que dados já existentes mostram a segurança da vacina, mas exigir a apresentação de estudos consolidados mais tarde.
Apenas a vacina da Pfizer contra a Covid pode ser aplicada em menores de idade, a partir de 5 anos.
O Ministério da Saúde avalia usar a Coronavac em crianças, caso haja aprovação da Anvisa. Como a vacina é do mesmo modelo aplicado em adulto s, estados já se planejam para destinar doses estocadas ao público mais jovem.
A vantagem da Coronavac é a disponibilidade de doses, devido ao fato de que o imunizante parou de ser usado pelo governo federal.
A vacinação de crianças e adolescentes é tema sensível no governo Jair Bolsonaro (PL), pois o mandatário distorce dados e desestimula a imunização dos mais jovens.
O presidente ainda é vetor de desinformação sobre a Coronavac, vacina impulsionada no Brasil pelo governador paulista João Doria (PSDB), inimigo político e potencial adversário do mandatário na disputa ao Planalto neste ano.
O governo de São Paulo estima ter capacidade de vacinar todas as crianças de 3 a 11 anos no estado contra a Covid-19 em cerca de dez dias.
Bolsonaro chegou a ameaçar expor nomes de servidores da Anvisa que aprovaram o uso de vacinas da Pfizer em crianças. Em resposta, o presidente da agência, Barra Torres, disse à Folha que as falas do chefe do Executivo estimulavam crimes de ameaça contra o órgão regulador.
Em nota divulgada no último dia 8, Barra Torres ainda rebateu insinuações de supostos interesses escusos da Anvisa na vacinação de crianças, e cobrou retratação do presidente.
Notícias ao Minuto Brasil – Brasil